Fue descrito en 1967 por Ashbaugh (Lancet, 1967) como una entidad con características clínicas, fisiológicas y radiológicas que desarrolla insuficiencia respiratoria aguda en el curso de distintas enfermedades. Se describió que todos los pacientes presentaban disnea, taquipnea, hipoxemia refractaria al tratamiento con altas fracciones inspiradas de oxígeno, descenso de la distensibilidad pulmonar e infiltrados alveolares difusos en la radiografía de tórax.
Definición: Estado clínico caracterizado por comienzo súbito de taquipnea, disnea, hipoxemia refractaria a altas fracciones inspiradas de oxígeno, infiltrados difusos alveolares y pérdida de la distensibilidad pulmonar.
Cada uno de estos criterios por sí mismos son inespecíficos, pero todos juntos identifican a los pacientes con SDRA, sea cual fuere su etiología.
CRITERIOS DE LA CONFERENCIA DE CONSENSO EUROPEA AMERICANA
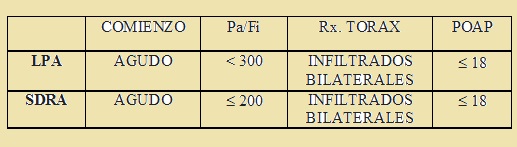
La Conferencia de Consenso definió que se trata de un síndrome agudo que puede aparecer a cualquier edad.
No se tiene presente el nivel de PEEP.
La lesión pulmonar aguda (LPA) y el SDRA representan una continuidad del mismo síndrome, ya que comparten los factores de riesgo, el pronóstico y la mortalidad.
Se excluyen los pacientes con edema pulmonar hidrostático, ya sea por insuficiencia ventricular izquierda o por sobrecarga de volumen, porque el mecanismo de producción es diferente.
También se excluyen los pacientes con enfermedades respiratorias crónicas, donde el criterio de comienzo agudo no se cumple.
Criterios diagnósticos de SDRA (de Petty)
-Presentación aguda
-Enfermedad de base
Factores de riesgo
Exclusiones
-EBOC
-Insuficiencia ventricular izquierda
Signos y síntomas clínicos
-Disnea
-Taquipnea
-Cianosis
Signos radiológicos
-Infiltrados difusos intersticiales
-Infiltrados difusos alveolares
Signos fisiológicos
-PaO2 < 50 mmHg con FiO2 > 0.6
-Distensibilidad pulmonar < 40 ml/cmH2O
-Aumento del Qs/QT
-Aumento del VD/VT
Signos patológicos
-Edema, hemorragia intraalveolar
-Atelectasias congestivas
-Membrana hialina
-Fibrosis
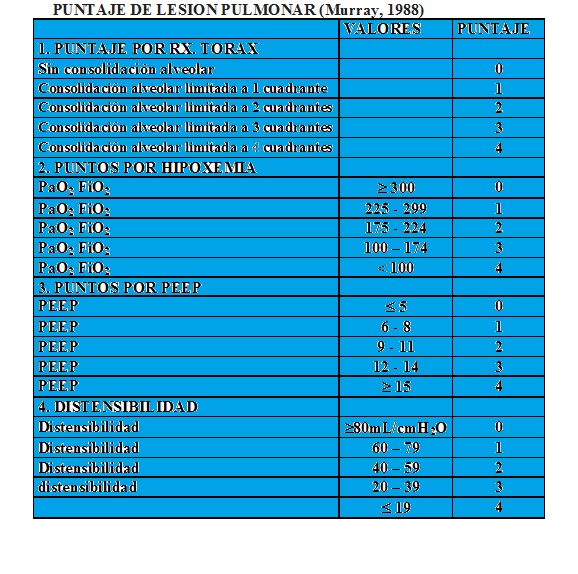
Se considera SDRA o LPA grave a un puntaje > 2.5.
De 0.1 a 2.5 se considera LPA leve.
Pueden usarse indistintamente el puntaje de lesión pulmonar >2.5 y la definición de SDRA de la AECC
Factores de riesgo
Lesión pulmonar
Aspiración de contenido gástrico
Infección pulmonar
Los más frecuentes
Trauma torácico
Casi ahogamiento
Lesión por inhalación
Lesión extrapulmonar:
Sepsis
Trauma severo no torácico
Hipertransfusión por reanimación de emergencia
Otras:
Shock, embolismo graso, pancreatitis, Neumonías difusas (adenovirus, CMV, P. Carinii, Legionella) grandes quemados, sobredosis (heroína, metadona, acido acetilsalicílico, propoxifeno, tricíclicos) hipersensibilidad a medicamentos (hidroclorotiacida, colchicina, ampicilina, medios de contraste), púrpura trombocitopénica trombótica, leucemias mieloproliferativas, drogas citotóxicas, embolismo aéreo, hipertensión endocraneana, circulación extracorpórea y hemodiálisis, edema de altitud, edema de reperfusión, inhalación de gases irritantes.)
El factor de riesgo más frecuente en todas las series es la sepsis
Tradicionalmente se ha considerado que, independientemente de la agresión primaria, el mecanismo de lesión será el mismo: Daño alveolar difuso
Otros autores hacen diferencia:
La lesión pulmonar primaria se caracteriza por un patrón predominantemente de consolidación, con infiltrados en parches, con elastancia pulmonar aumentada y elastancia de la pared torácica normal.
En la extrapulmonar el patrón histológico predominante será el edema intersticial y el colapso alveolar, y el patrón radiológico será el de opacidad en vidrio esmerilado. La elastancia de la pared torácica estará aumentada.

Patogenia
Las células endoteliales y el epitelio alveolar sufren daño en pacientes con SDRA. Los neumonocitos II se ven afectados en parte por daño directo a las células. La permeabilidad del epitelio alveolar se incrementa y la capacidad de las células epiteliales para el transporte de sodio se altera con el daño pulmonar. Debido a que el transporte de sodio es responsable de remover el exceso de líquido alveolar, se cree que la alteración de este metabolismo es el responsable de la acumulación de líquido alveolar.
Pacientes en los que la reabsorción de líquido alveolar no se reabsorbe en las primeras doce horas tienen peor pronóstico comparados con los que no tienen trastornos de la reabsorción.
Alteración del surfactante: En pacientes con distrés la tensión de la superficie alveolar está alterada debido a una disminución del contenido de fosfolípidos, principalmente el fosfatidilglicerol, y a un aumento del contenido de otros componentes del surfactante como fosfatidilinositol, fosfatidiletanolamina y esfingomielina; además, existe una disminución de la cantidad de apoproteínas específicas A y B. Estos cambios probablemente sean el reflejo del daño a los neumonocitos tipo II. Además, debido al aumento de la permeabilidad capilar existen proteínas de origen plasmático en el espacio alveolar, lo que contribuye a la destrucción del surfactante y a la inestabilidad alveolar, facilitando la formación de atelectasias y la disminución de la distensibilidad pulmonar.
Efecto de los mediadores inflamatorios: El SDRA es una enfermedad sistémica.
La activación de leucocitos y el reclutamiento de granulocitos en los pulmones ocurren en forma temprana en pacientes con distrés y son mediados en parte por la acción del factor de necrosis tumoral a y las interleuquinas 1, 6 y 8 .
El incremento en el número de neutrófilos promueve y prolonga la respuesta inflamatoria, sin embargo el neutrófilo no está presente en todos los casos de SDRA.
Independientemente de la etiología del daño pulmonar, cuando el síndrome ya está establecido muchas citoquinas se encuentran elevadas en el líquido del lavado broncoalveolar.
El factor inhibitorio de macrófagos, elaborado por el macrófago alveolar, es otra citoquina proinflamatoria importante en el distrés y contrarresta la acción antiinflamatoria de los esteroides.
Otro compuesto que influye sobre la evolución del proceso inflamatorio y la acción de las citoquinas son las moléculas de adhesión, otros mediadores y enzimas que interactúan con las citoquinas son los radicales libres de oxígeno, oxigeno reactivo, mediadores lipídicos (leucotrienos, eicosanoides, factor de activación plaquetaria, cascada del complemento y las enzimas colagenolíticas).
Anatomía patológica
La sintomatología clínica del SDRA se produce como consecuencia de graves lesiones microscópicas pulmonares difusas.
Lesiones anatomopatológicas
Macroscópicas. Aumento de peso y de consistencia de los pulmones, el peso puede alcanzar los dos kilogramos en cada pulmón (normal aprox. 400 gr). La superficie presenta una coloración rojizo violácea con abundantes petequias; al corte se aprecia intensa congestión, con abundante edema y exudado sanguinolento
Lesiones mircroscópicas. Daño alveolar difuso:Congestión y edema, inflamación intersticial, presencia de membranas hialinas y fibrosis intersticial difusa.
Fases:
Aguda exudativa: Las lesiones se producen entre el comienzo de la enfermedad y el final de la primera semana. Consiste en congestión capilar pulmonar y engrosamiento de la pared alveolar y de los septos interlobulillares producidos por edema no cardiogénico. Se detecta la presencia de un material eosinófilo y acelular, que se localiza cubriendo la superficie de los conductos alveolares y que recibe el nombre de membrana hialina, que si bien pueden presentarse en las primeras 24 horas, son más prominentes entre el cuarto y séptimo día posterior al daño pulmonar.
Se ha demostrado la presencia de leucocitos, independientemente de la causa del origen del SDRA.
Las células más afectadas son los neumonocitos tipo I y, en menor proporcion, las células endoteliales
Proliferativa o de organización: Abarca entre los 6 y los 14 días del comienzo del SDRA, la severidad y extensión del edema es menor que en el estadío anterior.
El hallazgo más característico es la hiperplasia e hipertrofia de los neumonocitos tipo II. En esta fase el daño de la membrana basal es más acentuado e impide la regeneración de los neumonocitos tipo I. Otra importante característica de esta fase es la formación de tejido de granulación, el cual se origina del exudado proteico y de las membranas hialinas presentes en el espacio alveolar. Este proceso conduce a la fibrosis pulmonar.
En esta fase es manifiesta la presencia de microtrombos en las pequeñas arterias y venas intraacinares, hay hipertrofia de la capa muscular de las arterias de pequeño calibre que se manifiesta por hipertensión pulmonar.
En esta fase el paciente clínicamente se presenta como un cuadro que no mejora, comienza a tener fiebre, leucocitosis y empeoramiento en los infiltrados radiográficos o nuevos infiltrados pulmonares (pueden estar presentes en el 40% de los casos y pueden confundirse con otras patologías). El diagnóstico de certeza es por biopsia.
Fase fibrótica. Ocurre en la minoría de los pacientes, en los que la fase proliferativa persiste sin autorregulación. Esta fase es debida en parte a la presencia de eventos caracterizados por inflamación como la sepsis persistente, neumonías nosocomiales y fracciones elevadas de oxígeno.
Actualmente la mayoría de pacientes que mueren debido al distres no tienen evidencia de fibrosis pulmonar.
Es en esta fase en la cual pueden administrarse como tratamiento: Corticoides durante 4 semanas, previo BAL para descartar neumonía y BAL semanalmente.

Secuelas
Físicas
Respiratorias: A los seis meses alcanzan su máxima recuperación
Neuropsicológicas: Diferentes grados de deterioro cognitivo generalizado y trastornos afectivos difusos
Causas:
- Asociadas con hipoxemia, embolia, toxicidad por drogas (especialmente las usadas para sedoanalgesia).
- Debido al síndrome de stress postraumático, vinculado con experiencias traumáticas durante la estadía en UTI. Este síndrome está caracterizado por:
-Sentimientos de miedo horror y espanto
-Coexistencia con depresión, abuso de drogas e intentos de suicidio.
Dr. Gastaldi, Pablo Andres / Especialista en Terapia Intensiva y Medicina Critica.
Especialista en Toxicologia / MN 119.321






















Excelente información!Gracias
Paciente con SDRA en nuestra institución es cándidato a protocolo de pronación, previo reclutamiento.
Estadísticamente es indicación médica para este tipo de patología y de otras afecciones respiratorias.
Muy bueno !
Excelente artículo. El SDRA es uno de los grandes desafíos para el profesional de la salud, ya sea tanto en el diagnostico como en el abordaje inicial, fundamentalmente, en contexto de pacientes que se presentan a los servicios de Emergencias con IVA y se desconocen sus antecedentes patológicos y de enfermedad actual, cruciales, para enfocar el diagnóstico presuntivo.
Saludos, cordiales.
Muy buena información! Gracias por compartirlo,…este tipo de pacientes es un desafío en la cual el equipo interdisciplinario debemos estar capacitados y trabajar en conjunto para una respuesta favorable y rápida. Saludos!
Muchas gracias a todos por comentar. Gracias a ustedes es que Epidauro ya cumplió un año y va por más. Muchísimas gracias!!
Hola colegas el tratamiento que utilizamos en la HUCI es la pronación que en muchos casos puede ser una buena alternativa..